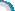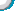一、探究题
1.某科学兴趣小组对潜艇的制氧原理产生了好奇,通过查阅资料得知,潜艇中制取氧气的主要原料是固体过氧化钠(Na2O2),过氧化钠分别能和二氧化碳、水反应,都能生成氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑:2Na2O2+2CO2=2Na2CO3+O2↑
为测定潜艇中过氧化钠的质量分数,该小组的同学在教师的指导下,利用下图所示的装置(固定装置已略去)开展探究,并得出正确结论。
已知装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物。整套装置气密性良好,反应所需试剂均足量。
请回答下列问题:
(1)装置B的作用是______。
(2)在A中不用稀硫酸而用稀盐酸原因______。
(3)装置E作用______。
(4)装置D中过氧化钠样品的质量为mg,装置D在反应前后质量分别为n1g和n2g,若样品中所含杂质既不溶于水,也不参加化学反应,求样品中过氧化钠的质量分数______?
2.某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性; |