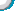一、表格型计算
1.为了检测实验室中石灰石样品中碳酸钙的含量,某同学用溶质质量分数相同的盐酸与样品进行了四组实验测定(样品中的杂质不溶于水,且不与盐酸反应),测得数据如表。试回答:
|
|
甲 |
乙 |
丙 |
丁 |
|
所取石灰石质量/g |
10.0 |
10.0 |
10.0 |
10.0 |
|
加入盐酸质量/g |
20.0 |
30.0 |
45.0 |
50.0 |
|
剩余固体质量/g |
6.0 |
4.0 |
2.0 |
2.0 |
(1)各组充分反应后,盐酸有剩余的实验组别是______;
(2)石灰石样品中碳酸钙的质量分数是多少______?
(3)实验所用稀盐酸的溶质质量分数是多少______?
2.为测定久置于空气中的氢氧化钠样品的变质程度,某化学兴趣小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配制成50g溶液,再向锥形瓶中滴加稀硫酸,反应过程中产生气体质量的部分实验数据和锥形瓶中溶液质量变化的情况如右表所示。
|
加入稀硫酸的质量/g |
40 |
65 |
75 |
|
产生气体的质量/g |
1.1 |
2.2 |
2.2 |
(1)配制50g溶液时需要使用玻璃棒,其作用是___________。
(2)6.5g样品与稀硫酸完全反应产生气体的质量是___________ g。
(3)在6.5g样品中,碳酸钠的质量分数是多少? (结果精确至 0.1%)
3.实验室取二氧化碳时,选择合适溶质质量分数的盐酸,有利于减少盐酸浪费。小明分别取400克溶质质量分数为7.3%、14.6%、21.9%的盐酸与足量的石灰石反应,进行A、B、C三组实验,产生二氧化碳的快慢与时间关系如图所示,算得盐酸利用率如表(盐酸利用率是指收集到的气体体积理论上所需要的盐酸量与实际消耗的盐酸总量的比值)。
|
盐酸利用率与盐酸溶质质量分数的关系 |
|
组别 |
A |
B |
C |
|
盐酸溶质质量分数 |
7.3% |
14.6% |
21.9% |
|
盐酸利用率 |
82.5% |
81.5% |
72.1% |
(1)小明在实验过程中发现,发生装置中的锥形瓶外壁发烫。推测图中c组在第5~10分钟时反应快速变慢的主要原因是___________。
(2)小明用400克盐酸进行A组实验,可收集到二氧化碳气体约多少升?___________(盐酸与石灰石反应的化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑,常温常压下二氧化碳的密度约为2克/升)
(3)实验中,小明想在10分钟内制取10升二氧化碳气体,综合考虑各种因素,选用哪种溶质质量分数的盐酸更合适,并说明理由。___________ |