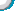本章回顾
专题1 金属与金属材料
1.金属的物理性质:大多数金属呈银白色或灰色;除汞(俗称水银)外,大多数金属室温下为固体,具有良好的导电性、导热性和延展性。
2.金属的化学性质:
(1)某些金属能与氧气发生化合反应生成金属氧化物。
(2)活泼金属(金属活动性顺序中氢之前的金属)能与酸发生置换反应生成盐和氢气。
(3)一些金属能与某些盐溶液发生置换反应生成新金属和新盐。
3.金属活动性顺序(由强到弱):K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au。
4.合金:把一种金属跟其他一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质。如生铁和钢是铁的两种合金。合金往往比纯金属有更好的性能。
5.防止金属锈蚀的方法有保护膜法和改变金属内部结构法。
例1 现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是( B )
A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
专题2 有机物与有机合成材料
1.有机物:一类含有碳元素的化合物(碳的氧化物、碳酸与碳酸盐除外)。如甲烷(CH4)、丁烷(C4H10)、乙炔(C2H2)。
2.大多数有机物易挥发、可燃烧、不易导电,不易溶于水。
3.人体内最基本的有机物有蛋白质、糖类、脂肪等,它们对生命活动有着重要的意义。
4.有机合成材料主要成分是用人工合成的方法制得的高分子化合物,通常有合成塑料、合成纤维和合成橡胶等。
例2 甲烷(CH4)是天然气的主要成分。乙炔(C2H2)又称电石气,工业上常用它燃烧产生的高温切割和焊接金属。
(1)CH4属于__化合物、有机物__(填“混合物”“单质”“化合物”“无机物”或“有机物”中的两项)。
(2)写出C2H2完全燃烧的化学方程式:__2C2H2+5O24CO2+2H2O__,该反应__放热__(填“放热”或“吸热”)。
(3)比较所含碳元素的质量分数大小:CH4__<__(填“<”“=”或“>”)C2H2。
专题3 酸、碱、盐除杂技巧
1.被提纯物质与杂质所含阳离子相同时,选取与杂质中的阴离子不共存的阳离子,再与被提纯物中的阴离子组合出除杂试剂。如除去Na2SO4中含有的少量NaOH,可选用稀H2SO4为除杂试剂(生成物为Na2SO4和H2O,达到目的)。 |