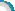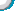表格型化学计算

1.文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5 g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),发生反应的化学方程式为2HCl+Zn=== ZnCl2+H2↑,记录所加锌粉质量与产生氢气的质量如下表所示:
|
次数 |
1 |
2 |
3 |
4 |
|
锌粉质量/g |
5 |
5 |
5 |
5 |
|
氢气质量/g |
0.15 |
0.15 |
0.1 |
0 |
请帮文文计算稀盐酸的溶质质量分数。
2.为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20 g固体混合物置于烧杯中,将100 g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
|
次序 |
① |
② |
③ |
④ |
|
加入稀硫酸的质量/g |
25 |
25 |
25 |
25 |
|
剩余固体的质量/g |
16 |
a |
10 |
10 |
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为________。
(2)上表中,a的值为________,实验③所得溶液中的溶质是__________________(填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
3.某课外活动小组为测定某不纯锌粒中含锌的质量分数,取来了一些锌粒样品,并取稀硫酸800 g,平均分成4份,将四份不同质量的样品加入到四份稀硫酸中,进行实验(杂质不与稀硫酸反应),结果如下:
|
实验 |
1 |
2 |
3 |
4 |
|
加入样品的质量/g |
6.5 |
13 |
19.5 |
26 |
|
生成H2的质量/g |
0.16 |
0.32 |
0.40 |
m |
(1)上表中m 的数值是________;
(2)试计算这种锌粒样品中锌的质量分数(写出计算过程)。
|