(A4纸汇编10页+答案2页,共12页)
1.(滨江-28)MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3并含有MnCO3、SiO2等杂质)制取MgSO4·7H2O的实验流程如下;
已知: ①氧化过程发生的化学反应是MnSO4+NaClO+H2O===MnO2+NaCl+H2SO4;
②SiO2不溶于稀硫酸。
(1)酸浸时,为了提高反应速率,可以采取的措施是 。
(2)写出酸浸时MgCO3发生反应的化学反应方程式: 。
(3)过滤2得到的滤液在浓缩结晶后,要经过 、洗涤、干燥等步骤才可得到MgSO4·7H2O。
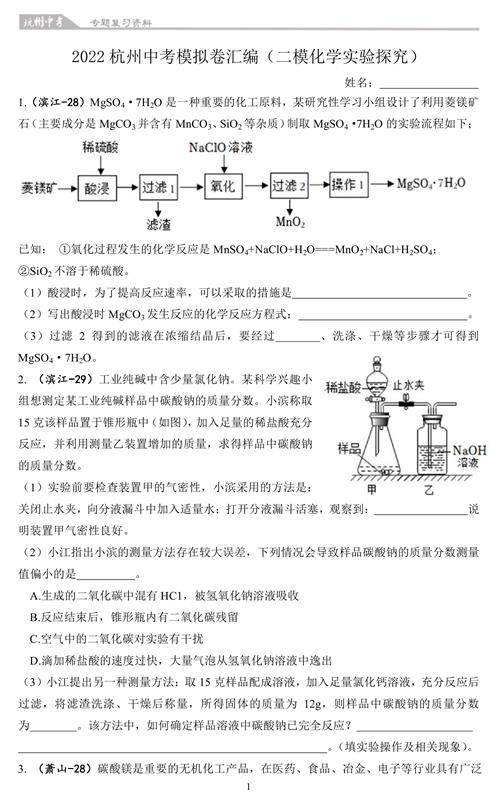
2. (滨江-29)工业纯碱中含少量氯化钠。某科学兴趣小组想测定某工业纯碱样品中碳酸钠的质量分数。小滨称取15克该样品置于锥形瓶中(如图),加入足量的稀盐酸充分反应,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。
(1)实验前要检查装置甲的气密性,小滨采用的方法是:关闭止水夹,向分液漏斗中加入适量水;打开分液漏斗活塞,观察到: 说明装置甲气密性良好。
(2)小江指出小滨的测量方法存在较大误差,下列情况会导致样品碳酸钠的质量分数测量值偏小的是 。
A.生成的二氧化碳中混有HC1,被氢氧化钠溶液吸收
B.反应结束后,锥形瓶内有二氧化碳残留
C.空气中的二氧化碳对实验有干扰
D.滴加稀盐酸的速度过快,大量气泡从氢氧化钠溶液中逸出
(3)小江提出另一种测量方法:取15克样品配成溶液,加入足量氯化钙溶液,充分反应后过滤,将滤渣洗涤、干燥后称量,所得固体的质量为12g,则样品中碳酸钠的质量分数为 。该方法中,如何确定样品溶液中碳酸钠已完全反应?
。(填实验操作及相关现象)。
3. (萧山-28)碳酸镁是重要的无机化工产品,在医药、食品、冶金、电子等行业具有广泛
|