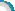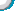1.有Mg、Fe、Cu的混合粉末,分离并得到MgSO4·7H2O过程如下:
(1)固体B是________.
(2)操作②中用到的主要玻璃仪器有______、玻璃棒和烧杯等.
(3)操作③主要包含蒸发浓缩、_____、过滤、洗涤烘干等.
(4)实验中可选用适量的下列试剂中的______代替稀H2SO4(填标号)
a CuSO4溶液 b FeSO4溶液 c 稀盐酸
2.废弃金属是重要的可再生资源,利用化学工艺可回收处理大量废旧电器。某品牌电器的废旧电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属)等金属,如图所示是某车间回收部分金属的工艺流程。已知: ,Ni与酸反应生成正二价离子。根据信息回答下列问题:
(1)操作Ⅰ中加入足量稀硫酸的目的是______,滤液①中含有的金属阳离子是______ (填离子符号)。
(2)根据以上工艺流程,可以得出Ni、Fe的金属活动性强弱顺序是Ni______Fe(填“<”或“>”=)。
(3)滤渣②中含有的金属是______,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入______,当看到______的现象时,表明铁已完全除尽。
(4)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是______。
3.实验室有氧化铜和铁的混合粉末,为除去其中的铁得到纯净的铜,设计了如图所示流程:
(1)溶液A中溶质除了FeSO4和CuSO4外,还有____。
(2)步骤Ⅱ中加入过量铁粉,能观察到有气泡产生且有红色固体析出,请写出有红色固体析出时发生反应的化学方程式______。
(3)步骤Ⅱ和步骤Ⅲ后都要经过____操作,其中玻璃棒的作用是________。
(4)选用一种物理方法分离滤渣B中的两种物质,该方法是_______。
4.生铁用途十分广泛。工业上利用赤铁矿(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图:
回答下列问题:
(1)“高炉气体”中的______(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成CO的反应之一为: ,该反应属于______(填基本反应类型)反应。
②用化学方程式表示利用CO炼铁的原理:______。
(3)生活中铁制品锈蚀的过程实际上是Fe与______、______等发生化学反应的过程。
5.高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌。 |